创新医疗器械临床试设计案例-肺动脉支架
产品名称:肺动脉支架
企业名称:北京迈迪顶峰医疗科技有限公司
医院数量:5家
临床试验描述:结合该产品为临床急需的优先审批医疗器械,对临床评价 资料进行了综合评价。 该产品以临床试验方式进行临床评价。临床试验的目的是 评价肺动脉支架治疗肺动脉狭窄的安全性和有效性,临床试验 采用前瞻性、多中心、单组设计。 临床试验在 5 家临床机构开展,入组 70 例受试者。主要评 价指标为支架扩张术成功率,次要评价指标为术后 3 个月、6 个 月、12 个月时再狭窄发生率,安全性指标为不良事件发生率。 全分析集(FAS)包含患者 69 例,靶病变为 72 处;符合方 案集(PPS)包含患者 67 例,靶病变为 70 处;安全集(SS)包 含患者 70 例。 主要评价指标结果如表 3 所示,95%可信区间估计表明研究假设成立。
次要评价指标结果如表4所示。术后3个月随访支架内血管 再狭窄率为0.00%(0/58)、术后6个月随访支架内血管再狭窄 率为0.00%(0/61),术后12个月随访支架内血管再狭窄率为 4.92%(3/61)。

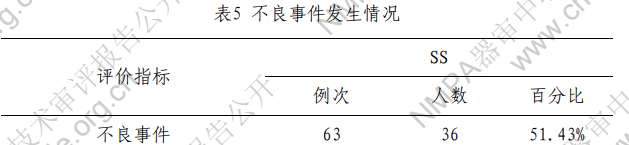
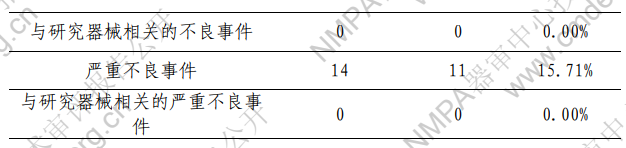
不良事件的发生情况见表5,与器械相关的不良事件为 0.00%。
操作性能符合临床使用需求。
【关于我们】
南京西格玛医学技术股份有限公司,总部地处南京,业务覆盖全国。西格玛医学是一家专业从事医疗器械临床研究的创新型CRO,证券代码:873450,致力于为医疗器械提供临床试验专项服务、临床研究、方案撰写、统计分析、数据管理、临床监查、器械SMO、受试者招募、器械第三方稽查和器械注册申报的整体解决方案。
自2009年成立至今,先后更名为南京西格玛咨询中心,南京西格玛医药技术。多年评为江苏高新技术企业,江苏省医疗器械协会会员,通过ISO9001质量体系和多家国内外企业现场认证,和苏州大学,东南大学、南京医科大学成立联合工作站,已成功为遍布25个省份的国内外近千家客户提供专业技术服务,成功完成方案设计撰写、临床监查、数据管理、统计分析、稽查、注册申报等,并建立长期稳定的合作关系。涉及主要的30余个治疗领域,骨科、眼科、肾内科、护理部、整形外科、医疗美容、检验科、ICU、心内科,心外科,病理科、皮肤科等,与全国25个省份近千家医院开展合作,并在国内主要省市设立一站式服务,与全国80%的临床试验机构密切合作,拥有一支稳定并按照国内NMPA、国际标准(ICH-GCP)临床操作的专业团队,具有完整规范详细的标准操作规程(SOP),提供符合NMPA、FDA、EU MDR要求的试验及报告,成功完成NMPA医疗器械Ⅲ类产品临床试验1000余个。项目多次通过国家局、省局和外部审核和稽查。为更好服务和方便客户,我们在全国多个省市开设了上海南格分公司、北京、苏州、西安、长沙、广东等办事处。
【联系我们】
地址:江苏省南京市鼓楼区汉中路180号星汉大厦20楼AB座、CD座
电话:025-86210646
手机:同微信13585209568、13913960642
网址:http://www.sigma-stat.com/