创新医疗器械临床试设计案例-甲型/乙型流感及呼吸道合胞病毒核酸 联合检测试剂盒(实时荧光 PCR 法)
产品名称:甲型/乙型流感及呼吸道合胞病毒核酸 联合检测试剂盒(实时荧光 PCR 法)
企业名称:美国赛沛公司 Cepheid
医院数量:3家
临床试验描述:申请人在湖北省疾病预防控制中心、首都医科大学附属北京儿童医院和南方医科大学珠江医院进行了临床试验。采用申 报产品与核酸序列测定方(对比方法)对临床样本进行比较研究,验证本产品的临床性能,对检测结果不一致的样本用第 — 13 — 三方复核方法进行检测。 本临床试验共收集了 1291 例患者鼻咽拭子样本,最终纳入 统计学分析的有效患者样本为 1152 例。 与对比方法的比较研究结果显示:针对甲型流感病毒,申 报产品与对比方法的阳性符合率、阴性符合率和总符合率分别 为 96.71%、95.53%和 95.75%,Kappa 值为 0.8673;针对乙型流 感病毒,申报产品与对比方法的阳性符合率、阴性符合率和总 符合率分别为 99.65%、93.08%和 94.70%,Kappa 值为 0.8670,; 针对呼吸道合胞病毒,申报产品与对比方法的阳性符合率、阴 性符合率和总符合率分别为 100.00%、94.78%和 95.14%,Kappa 值为 0.7135。对于检测结果不一致的样本,均进一步进行了第 三方复核方法的检测,并对结果进行了分析和解释。 甲型流感病毒 H1 亚型、H3 亚型和 H7N9 样本等检测结果显 示申报产品对甲型流感病毒 H1、H3 和 H7 亚型有很好的检测能 力。交叉反应性结果显示不会由于其他呼吸道病原体感染而得 到申报产品的假阳性结果。部分样本的流感病毒培养鉴定结果 显示针对甲型流感病毒和乙型流感病毒,申报产品与培养鉴定 结果有高度的一致性。 综上所述,该产品临床试验资料对产品的临床性能进行了较全面研究,临床试验基本符合要求。
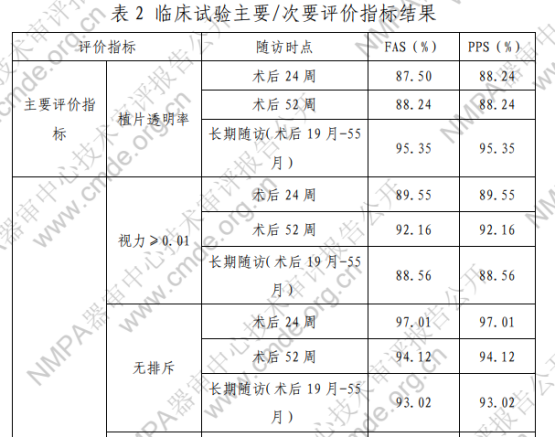
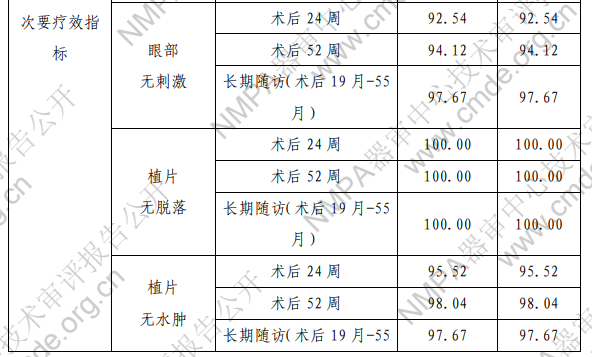
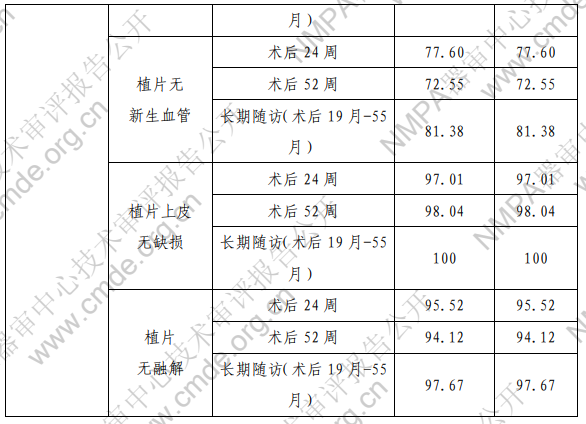
注:术后 52 周和长期随访的数据按照所观察到的试验者情 况进行计算。
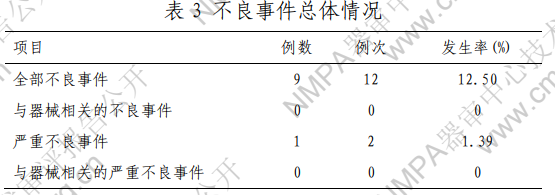
(六)安全性评价指标:(1)生命体征、实验室检查、 心电图检查入组前后均为正常或虽异常但无临床意义。(2) 不良事件发生情况如表 3 所示,无与器械相关的不良事件和 严重不良事件。
(七)不同病原体感染类型的有效性分析 针对不同病原体感染的患者进行了有效性分析。在术后 24 周时仅有真菌感染患者的角膜植片透明率FAS 统计为 90.38(79.39,95.82),PPS 统计为90.20(79.02,95.74), 研究假设成立。由于该上市前临床试验中其它感染类型的患 者入组较少,目前针对细菌感染、病毒感染、阿米巴感染及 混合感染的患者尚缺乏较为充分临床支持性数据。 (八)本产品用于治疗未累及全层的真菌性角膜溃疡有 效性达到目标值设计要求,不良事件发生率可接受。在目前 国内同种异体角膜较为紧缺的背景下,经综合评价,在目前认知水平上,对于系统用药治疗 2 周以上无效并有手术指征 的真菌性角膜溃疡患者,申报产品为该部分患者带来的受益 大于风险。
【关于我们】
南京西格玛医学技术股份有限公司,总部地处南京,业务覆盖全国。西格玛医学是一家专业从事医疗器械临床研究的创新型CRO,证券代码:873450,致力于为医疗器械提供临床试验专项服务、临床研究、方案撰写、统计分析、数据管理、临床监查、器械SMO、受试者招募、器械第三方稽查和器械注册申报的整体解决方案。
自2009年成立至今,先后更名为南京西格玛咨询中心,南京西格玛医药技术。多年评为江苏高新技术企业,江苏省医疗器械协会会员,通过ISO9001质量体系和多家国内外企业现场认证,和苏州大学,东南大学、南京医科大学成立联合工作站,已成功为遍布25个省份的国内外近千家客户提供专业技术服务,成功完成方案设计撰写、临床监查、数据管理、统计分析、稽查、注册申报等,并建立长期稳定的合作关系。涉及主要的30余个治疗领域,骨科、眼科、肾内科、护理部、整形外科、医疗美容、检验科、ICU、心内科,心外科,病理科、皮肤科等,与全国25个省份近千家医院开展合作,并在国内主要省市设立一站式服务,与全国80%的临床试验机构密切合作,拥有一支稳定并按照国内NMPA、国际标准(ICH-GCP)临床操作的专业团队,具有完整规范详细的标准操作规程(SOP),提供符合NMPA、FDA、EU MDR要求的试验及报告,成功完成NMPA医疗器械Ⅲ类产品临床试验1000余个。项目多次通过国家局、省局和外部审核和稽查。为更好服务和方便客户,我们在全国多个省市开设了上海南格分公司、北京、苏州、西安、长沙、广东等办事处。
【联系我们】
地址:江苏省南京市鼓楼区汉中路180号星汉大厦20楼AB座、CD座
电话:025-86210646
手机:同微信13585209568、13913960642
网址:http://www.sigma-stat.com/